โรคฉี่หนู เล็ปโตสไปโรซิส |
(Leptospirosis) |
| ธรรมชาติของการเกิดโรคเล็ปโตสไปโรสิส (Leptospirosis) | ||||
| ยุพิน ศุพุทธมงคล | ||||
โรคเล็ปโตสไปโรสิส เป็นโรคของสัตว์ที่ติดต่อมายังคน เกิดจากเชื้อ Leptospira interrogans ก่อให้เกิดพยาธิสภาพและอาการได้หลายระบบ ผู้ป่วยมีอาการและอาการแสดงแตกต่างกันได้ตั้งแต่ไม่รุนแรงหายได้เองจนเสียชีวิตได้ ปัจจุบันโรคเล็ปโตสไปโรสิสจัดเป็นโรคติดเชื้ออุบัติใหม่ (Emerging infectious disease) ที่สำคัญโรคหนึ่ง เนื่องจากพบการระบาดซึ่งแต่ละครั้งมีผู้ป่วยจำนวนมากในหลายภูมิภาค เช่น ที่ลาตินอเมริกา อเมริกาใต้ ซึ่งมีการระบาดที่ประเทศนิการากัว เมื่อปี พ.ศ. 2538 ที่ประเทศบราซิล ที่ประเทศอินเดียเมื่อปี พ.ศ. 2543 และในประเทศไทยเองก็มีการระบาดตั้งแต่ปี พ.ศ. 2539 เป็นต้นมา โดยมีรายงานอัตราป่วยต่อแสนประชากรเพิ่มขึ้นในหลาย ๆ จังหวัด ทางภาคตะวันออกเฉียงเหนือและแพร่กระจายไปยังภาคอื่น ๆ โดยเฉพาะภาคเหนือและภาคใต้ และพบว่าผู้ป่วยจำนวนหนึ่งมีอาการรุนแรง และอัตราตายสูง นอกจากนั้นยังพบการแพร่กระจายของเชื้อ leptospires ในสัตว์และสิ่งแวดล้อมอย่างกว้างขวาง และตรวจพบเชื้อชนิดต่าง ๆ ซึ่งไม่เคยมีรายงานมาก่อน ทำให้โรคเล็ปโตสไปโรสิสเป็นปัญหาสำคัญทางสาธารณสุขอย่างหนึ่งของประเทศไทยในขณะนี้ |
||||
| เชื้อก่อโรค | ||||
เชื้อ leptospires เป็นแบคทีเรียชนิด spirochete มีลักษณะเป็นเส้นเกลียวบางยาว 6- 25 มคม. กว้าง 0.25 มคม. มี flagella ที่ปลายข้างละ 1 เส้น เคลื่อนไหวโดยการหมุนและโค้งงอ เชื้อมีผนังหุ้ม 3-5 ชั้น และมีสาร lipopolysaccharide และโปรตีนหลายชนิดเป็นส่วนประกอบของผนังชั้นนอก ซึ่งเป็นแอนติเจนสำคัญ ที่นำมาใช้ในการตรวจเพื่อวินิจฉัยโรคนี้ เชื้อชนิดนี้เป็นแอโรบิกแบคทีเรีย ต้องอาศัย long chain fatty acid และสภาวะแวดล้อมที่เหมาะสมในการเติบโต อาทิเช่น ต้องมีความเป็นกรดและด่างปานกลาง (pH 6.8 7.6) อุณหภูมิที่เหมาะสมประมาณ 28 - 30 องศาเซลเซียส เป็นต้นและเจริญเติบโตในอาหารเลี้ยงเชื้อ ที่เป็นของเหลวได้ดีกว่าในวุ้นที่เป็นอาหารเลี้ยงเชื้ออื่น ๆ ทั่วไป โดยมี อัตราการเพิ่มจำนวน (doubling time) 6-8 ชั่วโมง |
||||
|
||||
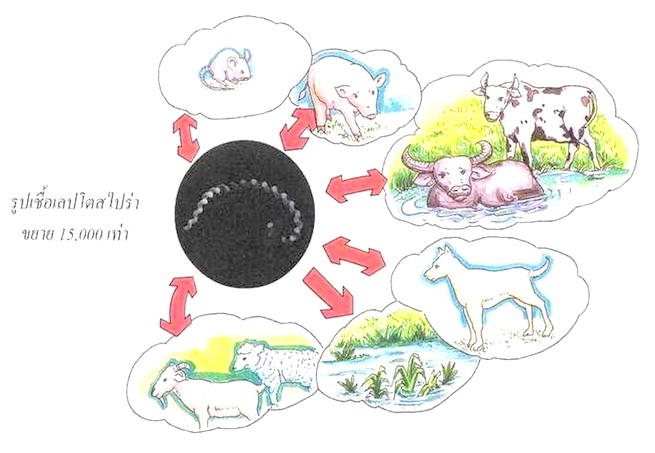
| เชื้อ leptospires สามารถมีชีวิตอยู่ในน้ำหรือในดินที่มีความชื้นและความเป็นกรดด่าง พอเหมาะดังกล่าวแล้วได้นานเป็นชั่วโมงหรือวัน โดยเฉพาะน้ำที่ไหลนิ่งเอื่อยๆ สัตว์ที่เป็นแหล่งรังโรคมีทั้ง สัตว์ป่าอาทิเช่น กระรอก กวาง สุนัขจิ้งจอก และสัตว์เลี้ยงต่าง ๆ เช่น สุกร หนู สุนัข โค กระบือและแมว เป็นต้น สัตว์เหล่านี้อาจไม่แสดงอาการใด ๆ แต่จะมีการติดเชื้อที่ท่อไตและปล่อยเชื้อออกมากับปัสสาวะได้เป็นเวลานาน หลายสัปดาห์ หลายเดือนหรืออาจตลอดชีวิต ทำให้เชื้อนี้สามารถแพร่กระจายในฝูงสัตว์จากการเลียกินปัสสาวะ การผสมพันธุ์หรือการสัมผัสปัสสาวะที่ปนเปื้อนในสิ่งแวดล้อมและมีการติดต่อมายังคนได้ เชื้อ leptospires แต่ละชนิดมีสัตว์ที่เป็นแหล่งรังโรคหลักๆต่างกัน เช่น เชื้อ serovar icteroheamorrhagiae และ copenhageni พบได้ในหนู ส่วนเชื้อ serovar pomona พบได้ในสุกร เชื้อ serovar hardjo พบได้ในโค กระบือ และเชื้อ serovar canicola พบได้บ่อยในสุนัข เป็นต้น (สัตว์จะไม่แสดงอาการป่วยถ้าติดเชื้อสายพันธ์ประจำชนิดของ สัตว์นั้น ๆ แต่ถ้าติดเชื้อต่างสายพันธ์จะป่วยได้) | ||||
 |
||||
| เชื้อ leptospires สามารถมีชีวิตอยู่ในน้ำหรือในดินที่มีความชื้นและความเป็นกรดด่างพอเหมาะ ดังกล่าวแล้วได้นานเป็นชั่วโมงหรือวัน โดยเฉพาะน้ำที่ไหลนิ่งเอื่อย ๆ สัตว์ที่เป็นแหล่งรังโรคมีทั้งสัตว์ป่าอาทิเช่น กระรอก กวาง สุนัขจิ้งจอก และสัตว์เลี้ยงต่างๆ เช่น สุกร หนู สุนัข โค กระบือและแมว เป็นต้น สัตว์เหล่านี้อาจ ไม่แสดงอาการใดๆแต่จะมีการติดเชื้อที่ท่อไตและปล่อยเชื้อออกมากับปัสสาวะได้เป็นเวลานานหลายสัปดาห์ หลายเดือนหรืออาจตลอดชีวิต ทำให้เชื้อนี้สามารถแพร่กระจายในฝูงสัตว์จากการเลียกินปัสสาวะ การผสมพันธุ์หรือ การสัมผัสปัสสาวะที่ปนเปื้อนในสิ่งแวดล้อมและมีการติดต่อมายังคนได้ เชื้อ leptospires แต่ละชนิดมีสัตว์ที่เป็น แหล่งรังโรคหลัก ๆ ต่างกัน เช่น เชื้อ serovar icteroheamorrhagiae และ copenhageni พบได้ในหนู ส่วนเชื้อ serovar pomona พบได้ในสุกร เชื้อ serovar hardjo พบได้ในโค กระบือ และเชื้อ serovar canicola พบได้บ่อยในสุนัข เป็นต้น (สัตว์จะไม่แสดงอาการป่วยถ้าติดเชื้อสายพันธ์ประจำชนิดของสัตว์นั้นๆแต่ถ้าติดเชื้อต่างสายพันธ์จะป่วยได้) | ||||
 |
||||
| โรคนี้พบได้ทั่วโลก แต่พบในเขตเมืองร้อนได้บ่อยกว่า พบได้ทุกกลุ่มอายุ แต่ผู้ชายเป็นโรคนี้มากกว่าผู้หญิง โรคติดต่อมาสู่คนโดยตรงจากการสัมผัสกับปัสสาวะที่มีเชื้อ ของสัตว์นำโรคหรือติดต่อทางอ้อมโดยเชื้อไชเข้าทางผิวหนังหรือเยื่อบุที่มีรอยแผลเมื่อคนไป สัมผัสกับน้ำหรือดินที่ปนเปื้อนเชื้อจากปัสสาวะของสัตว์ โดยคนที่เสี่ยงต่อการติดโรคสูงได้แก่ เกษตรกรผู้เลี้ยงสัตว์ ชาวนา ชาวไร่ คนงานโรงงานฆ่าสัตว์ กรรมกรขุดลอกคูคลอง สัตวแพทย์ เป็นต้น อย่างไรก็ตามนักท่องเที่ยวหรือผู้ที่เดินลุยน้ำ ว่ายน้ำและล่าสัตว์ก็มีโอกาสสัมผัสโรคนี้ได้ การแพร่กระจายโรคนี้โดยตรงจากคนถึงคนพบได้ โดยมีรายงานว่าโรคนี้สามารถติดต่อ จากแม่ไปสู่ลูกได้ขณะตั้งครรภ์และคลอด และทางการกินนมแม่ | ||||
| พยาธิกำเนิดและพยาธิสภาพ | ||||
เมื่อเชื้อ leptospires เข้าสู่ทางผิวหนังหรือเยื่อบุที่มีแผล เชื้อจะเข้าสู่กระแสเลือดภายใน 24 ชั่วโมง และการกระจายไปตามอวัยวะต่าง ๆ เนื่องจากเชื้อสามารถเคลื่อนไหวได้อย่างรวดเร็วจึงไม่มีการอักเสบที่ ตำแหน่งทางเข้าของเชื้อ เมื่อเชื้อเข้าสู่ร่างกายจะอยู่ในสภาวะแวดล้อมต่างจากภายนอกมาก อาทิเช่น ความเข้มข้นของเกลือ ความดันออสโมติก และอุณหภูมิร่างกายที่สูงกว่า ทำให้เชื้อ leptospires ซึ่งไม่ก่อโรค ไม่สามารถเจริญและแบ่งตัวได้ นอกจากนั้นการศึกษาในหลอดทดลองพบว่า เม็ดเลือดขาวและสารบางอย่าง ในน้ำเหลืองของคนปรกติสามารถทำลายเชื้อ leptospires ที่ไม่ก่อโรคได้ด้วย ส่วนเชื้อซึ่งก่อโรคได้สามารถ ปรับตัวเจริญเติบโตและเพิ่มจำนวนจนก่อให้เกิดพยาธิสภาพในอวัยะต่างๆได้ในคนที่ไม่เคยมีภูมิคุ้มกันต่อโรคนี้มาก่อน |
||||
| อาการทางคลินิกของผู้ป่วยโรคเล็ปโตสไปโรสิสแตกต่างกันได้มากตั้งแต่มีเพียงไข้ฉับพลัน คล้ายไข้หวัด ตัวและตาเหลือง ไตวาย ปอดอักเสบซึ่งอาจไม่รุนแรง หรือบางรายมีเลือดออกในปอดและการ หายใจล้มเหลวได้ ในปัจจุบันยังไม่ทราบกลไกที่แท้จริงซึ่งสามารถอธิบายอาการทางคลินิกที่แตกต่างกันได้มาก เช่นนี้ แต่เชื่อว่าเป็นพยาธิกำเนิดซึ่งเป็นผลรวมจากปฏิกริยาต่างๆที่เกิดจากตัวเชื้อโดยตรงร่วมกับปฏิกริยา การตอบสนองของระบบภูมิคุ้มกันของร่างกายเมื่อเกิดการติดเชื้อ ซึ่งข้อสนับสนุนสมมติฐานนี้ในเบื้องต้นได้แก่ ผลการศึกษาโครงสร้างทางพันธุกรรมที่สมบูรณ์ (complete genome) ของเชื้อ L. interrogans serovar lai ซึ่งพบว่า เชื้อ leptospires ประกอบด้วยยีนต่าง ๆ มากกว่าเชื้อ spirochete ชนิดอื่นๆถึง 4 เท่าและพบยีนจำนวนมากที่เกี่ยวข้องกับ กลไกต่าง ๆ ในการก่อโรค | ||||
| อาการทางคลินิกของผู้ป่วยโรคเล็ปโตสไปโรสิสบางส่วนซึ่งคล้ายคลึงกับอาการของโรคติดเชื้ออื่น ๆ เป็นผลจากสาร lipopolysaccharide และโปรตีนบางชนิดที่เป็นส่วนประกอบของผนังหุ้มเซลล์ชั้นนอกของเชื้อเช่น outer membrane protein 1 (OmpL 1) กระตุ้นเซลล์เม็ดเลือดขาวให้เกิดการหลั่งสารต่าง ๆ เช่น สาร tumor necrosis factor มาในกระแสโลหิตเช่นเดียวกับการติดเชื้อแบคทีเรียกรัมลบอื่น ๆ อย่างไรก็ตามพบว่า สาร lipopolysaccharide ของเชื้อ leptospires มีส่วนประกอบ คุณสมบัติแตกต่างจากเชื้อแบคทีเรียกรัมลบชนิดอื่น ๆ เช่น กระตุ้นเม็ดเลือดขาวชนิด macrophage ผ่าน Toll like receptor 2 (TLR2) แทนที่จะเป็น TLR4 เหมือนสาร lipopolysaccharide ของเชื้อแบคทีเรียกรัมลบทั่วไป และพบว่ามีความรุนแรงในการก่อโรคน้อยกว่า สาร lipopolysaccharide ของเชื้อแบคทีเรียอื่นๆด้วย นอกจากนั้นปัจจัยอื่นๆที่ทำให้เชื้อ leptospires ก่อโรคได้ (virulence factor) มีอีกหลายชนิด เช่น ความสามารถในการเคลื่อนที่ (motility) ทำให้เชื้อกระจายไป ตามอวัยวะต่างๆเช่น ตับ ไต ได้ในระยะแรกของการติดเชื้อ และเกิดพยาธิสภาพที่อวัยวะเหล่านั้นตามมา การศึกษาเกี่ยวกับโครงสร้างทางพันธุกรรมของเชื้อพบว่า มียีนอย่างน้อย 50 ชนิดที่มีความสัมพันธ์กับ ความสามารถในการเคลื่อนที่ของเชื้อนี้ เชื้อชนิดนี้สามารถสร้างเอ็นไซม์หลายชนิดซึ่งอาจเกี่ยวข้องกับ พยาธิกำเนิดของโรคเช่น hemolysin, sphingomyelinase, phospholipase และในปัจจุบันพบยีนหลายชนิดที่ ควบคุมเกี่ยวกับปฏิกริยาดังกล่าวในเชื้อชนิดนี้แล้วเช่นกัน นอกจากนั้นมีการศึกษาพบสารโปรตีนชนิดต่าง ๆ ที่เชื้อสร้างขึ้นที่อาจเกี่ยวข้องกับการเกิดพยาธิสภาพต่าง ๆ เช่น leptospiral immunoglobulin-like protein A (Lig A) ซึ่งช่วยให้เชื้อสามารถเกาะติดที่ผนังเซลล์และผ่านเข้าไปในเซลล์ของอวัยวะต่าง ๆ ได้และพบยีนอย่างน้อย 4 ชนิดซึ่งมีความสัมพันธ์กับการสร้างโปรตีนชนิดนี้เช่นเดียวกัน | ||||
| การศึกษาในสัตว์ทดลองพบว่าสามารถทำให้สัตว์ทดลองที่ติดเชื้อมีกลุ่มอาการต่าง ๆ ได้ขึ้นกับอายุ ชนิดของสัตว์ทดลอง ความรุนแรงและปริมาณของเชื้อที่ใช้ในการทดลอง โดยพบว่าสัตว์ที่ทำให้เกิดการติดเชื้อเรื้อรัง มักไม่มีพยาธิสภาพและไม่แสดงอาการแต่มีเชื้อสะสมอยู่บริเวณท่อไตและปล่อยออกมาในปัสสาวะเป็นจำนวนมากสัตว์ที่มี การติดเชื้อเรื้อรังตามธรรมชาติจึงน่าจะเป็นแหล่งแพร่เชื้อในสิ่งแวดล้อมที่สำคัญ ในทางตรงข้ามสัตว์ที่ทำให้เกิดการติดเชื้อ ชนิดฉับพลันมีอาการรุนแรงเช่นเดียวกับการติดเชื้อในมนุษย์ โดยพยาธิสภาพที่ตับและไตน่าจะเกิดจากเชื้อโดยตรง เนื่องจาก ความรุนแรงของพยาธิสภาพที่พบมีความสัมพันธ์โดยตรงกับปริมาณเชื้อที่ตรวจพบที่อวัยวะดังกล่าว แต่พยาธิสภาพที่ปอดอาจจะเป็นผลจากสารต่าง ๆ ที่หลั่งจากเชื้อที่อยู่ตามอวัยวะอื่น ๆ หรือจากปฏิกริยาภูมิคุ้มกันตอบสนอง ต่อการติดเชื้อของร่างกาย เนื่องจากมักตรวจพบเชื้อปริมาณน้อยที่ปอดแม้ในสัตว์ทดลองที่มีปอดอักเสบรุนแรง หรือมีเลือดออกในปอด และเคยมีรายงานว่า ผู้ป่วยที่มีอาการเลือดออกในปอดพบระดับแอนติบอดี ต่อเชื้อนี้ในระดับสูงกว่าผู้ป่วยที่ไม่มีภาวะดังกล่าว | ||||
| พยาธิสภาพของโรคนี้ในรายที่มีอาการรุนแรงพบมีการอักเสบของผนังหลอดเลือดแดง (vasculitis) เป็นผลให้อวัยวะต่างๆเช่น ตับ ไต ปอด เป็นต้น เกิดการอักเสบและทำงานผิดปรกติ ทำให้เกิดอาการตาและตัวเหลือง การอักเสบของเนื้อเยื่อไต (acute interstitial nephritis) ซึ่งทำให้ไตทำงานผิดปรกติหรือไตวายโดยอาจมีปัจจัยอื่น ๆ ร่วมด้วยเช่นเดียวกับโรคติดเชื้ออื่น ๆ ที่พบภาวะไตวายร่วมด้วย พยาธิสภาพของปอดส่วนใหญ่เป็นการอักเสบและมี เลือดออกในถุงลมปอดเช่นกัน ภาวะเลือดออกผิดปรกติซึ่งพบในรายที่มีอาการรุนแรงพบว่าไม่ได้เกิดจาก ภาวะเกล็ดเลือดต่ำหรือการแข็งตัวของเลือดผิดปรกติ แต่เป็นผลจากการอักเสบของเซลล์เยื่อบุผนังหลอดเลือดแดง ที่รุนแรงเช่นเดียวกัน กลไกการตอบสนองของระบบภูมิคุ้มกันของร่างกายต่อการติดเชื้อยังไม่เป็นที่ทราบแน่นอน แต่เชื่อว่า เกิดขึ้นทั้งระบบ humoral immune response และ cell- mediated immune response โดยมีรายงานว่า การติดเชื้อนี้ตามธรรมชาติทำให้เกิดการสร้างแอนติบอดี (serovar specific leptospiral lipopolysaccharide) ซึ่งป้องกันการติดเชื้อได้ อย่างไรก็ตามพบว่า อาจมีการติดเชื้อซ้ำได้แม้ในรายที่มีแอนติบอดีดังกล่าวในระดับสูง จึงเชื่อว่ามีกลไกอื่น ๆ ที่มีบทบาทในการ ป้องกันโรคด้วยเช่นกัน ปัจจุบันเริ่มมีรายงานว่าระบบ cell-mediated immune response น่าจะมีบทบาทใน โรคเล็ปโตสไปโรสิสด้วยเช่นกัน เช่น พบว่า เซลล์เม็ดเลือดขาวหลายชนิด เช่น เม็ดเลือดขาว CD4 และ γδ T cells ถูกกระตุ้นด้วยแอนติเจนจากเชื้อ leptospires ให้มีการเพิ่มจำนวนและสร้างสารต่าง ๆ เช่น interferon γ ซึ่งมีบทบาทเกี่ยวข้องกับการก่อโรคได้ เป็นต้น | ||||
| ลักษณะทางคลินิก | ||||
| โรคนี้มีระยะฟักตัวโดยเฉลี่ย 5-14 วัน ผู้ที่ได้รับเชื้อ leptospires จำนวนหนึ่งไม่มีอาการทางคลินิก (subclinical infection) โดยมีรายงานจากต่างประเทศพบผู้ซึ่งเคยติดเชื้อแต่ไม่แสดงอาการทางคลินิกได้ ตั้งแต่ ร้อยละ 37- 70 ส่วนผู้ป่วยที่มีอาการทางคลินิกอาจแบ่งเป็น 2 ระยะตามพยาธิกำเนิด |
||||
ระยะแรก (leptospiremic phase) เป็นระยะ 4-7 วันแรก ของการดำเนินโรคซึ่งสามารถแยกเชื้อได้จากเลือดและน้ำไขสันหลัง ผู้ป่วยจะมีอาการไข้สูงแบบทันทีทันใด ปวดศีรษะ ปวดเมื่อยกล้ามเนื้อมากโดยเฉพาะกล้ามเนื้อหลัง น่องและต้นคอและมีคลื่นไส้ อาเจียน อาการตาแดงซึ่งเป็นผลจากการที่เส้นเลือดในเยื่อบุตาขยายตัว โดยไม่มีการอักเสบเป็นหนองมักพบใน 3 วันแรกของโรคและเป็นอยู่ได้นานถึง 1 สัปดาห์ อาจพบมี อาการคอแข็ง ความดันโลหิตต่ำ การตรวจร่างกายอื่น ๆ ที่อาจพบได้แต่ไม่บ่อยได้แก่ ผื่นแดง ต่อมน้ำเหลืองโต ตับม้ามโต เป็นต้น |
||||
ระยะที่ 2 (immune phase) ระยะที่ 2 เป็นระยะหลังจากเริ่มมีอาการไข้ประมาณ 1 สัปดาห์ ซึ่งผู้ป่วยเริ่มสร้างภูมิคุ้มกันเพื่อ กำจัดเชื้อดังกล่าวแล้ว โดยจะมีช่วงที่ไข้ลงประมาณ 1-2 วันแล้วกลับมีไข้ขึ้นใหม่เข้าสู่ระยะที่ 2 นี้ ทำให้ไข้อาจมีลักษณะเป็น biphasic ในระยะนี้ผู้ป่วยมักมีอาการปวดศีรษะ ซึ่งไม่ค่อยตอบสนองต่อ ยาแก้ปวด อาจมีอาการสับสน ไข้ต่ำๆ คลื่นไส้ อาเจียนแต่ไม่รุนแรง เยื่อหุ้มสมองอักเสบ ม่านตาอักเสบ ผื่นและหน้าที่ของตับและไตผิดปรกติ ระยะนี้อาจกินเวลาตั้งแต่ 4 ถึง 30 วัน และจะพบเชื้อในเลือดและ น้ำไขสันหลังได้ใน 1-2 วันแรกและหลังจากนั้นเชื้อจะออกมาในปัสสาวะนาน 1-3 สัปดาห์ ผู้ป่วยซึ่งมี อาการรุนแรงจะมีไข้สูงลอยและมีอาการหรืออาการแสดงของระยะนี้ตั้งแต่ปลายสัปดาห์แรกของโรค โดยไม่มีช่วงที่ไข้ลดลง |
||||
| ผู้ป่วยโรคเล็ปโตสไปโรสิสอาจมีอาการแสดงทางคลินิกและการดำเนินโรคที่แตกต่างกันได้มาก อาทิเช่น ไข้ฉับพลันซึ่งหายได้เองหรือมีอาการข้างเคียงต่าง ๆ ที่อาจรุนแรงและทำให้เสียชีวิตได้ดังกล่าวแล้ว โดยทั่วไปแบ่งได้เป็นสองกลุ่มตามการพยากรณ์โรคดังนี้ 1. กลุ่มที่ไม่แสดงอาการตัวและตาเหลือง (anicteric leptospirosis) รายงานแตกต่างกันได้มากตั้งแต่ร้อยละ 5-95 ของผู้ติดเชื้อที่แสดงอาการทั้งหมด ผู้ป่วยกลุ่มนี้อาการไม่รุนแรงและอาจหายได้เอง อัตราตายต่ำ เชื้อที่มีรายงานว่า ทำให้เกิดโรคในกลุ่มนี้บ่อย ๆ เช่น serovar ballum หรือ serovar hardjo เป็นต้น 2. กลุ่มที่มีอาการรุนแรง ซึ่งมักมีอาการตัวและตาเหลือง (icteric leptospirosis or Weil's disease) เป็นกลุ่มที่ อาจเกิดภาวะแทรกซ้อนที่รุนแรงอาทิเช่น ไตวาย กล้ามเนื้อหัวใจอักเสบ เลือดออกผิดปรกติที่อวัยวะต่าง ๆ เป็นต้น กลุ่มนี้มีรายงานอัตราตายแตกต่างกันได้มากตั้งแต่ร้อยละ 5- 40 มักรายงานว่าเกิดจากการติดเชื้อใน serogroup icterohaemorrhagiae มากที่สุด การระบาดในประเทศไทยครั้งนี้พบว่า เกิดจากเชื้อ leptospires ชนิดอื่น ๆ อีกหลายชนิด เช่น serovar bratislava, serovar pyrogenes เป็นต้น |
||||
| อาการและอาการแสดงจำแนกตามระบบต่าง ๆ และตามความรุนแรงของโรค ซึ่งอาจช่วยในการวินิจฉัยแยกโรคเล็ปโตสไปโรสิสจากโรคติดเชื้ออื่น ๆ ที่มีอาการแสดงคล้ายคลึงกันได้แก่ ระบบกล้ามเนื้อ ผู้ป่วยโรคเล็ปโตสไปโรสิสมักมีอาการปวดกล้ามเนื้อที่รุนแรง โดยเฉพาะบริเวณกล้ามเนื้อน่องซึ่งพบได้บ่อย อาการกดเจ็บกล้ามเนื้อ (muscle tenderness) พบได้ร้อยละ 42-53 และร้อยละ 75 ในผู้ป่วยกลุ่มที่ ไม่มีและที่มีอาการตัวและตาเหลืองตามลำดับ และอาจพบระดับเอ็นไซม์ที่บ่งถึงการอักเสบของกล้ามเนื้อ เช่น creatine phosphokinase (CPK) สูงผิดปรกติได้บ่อยถึงร้อยละ 50 โดยมักขึ้นสูงสุดในสัปดาห์ที่สอง หรือในระยะฟื้นตัว ระบบทางเดินอาหาร อาการผิดปรกติที่อาจพบได้แก่ คลื่นไส้ อาเจียน ท้องเสีย การกดเจ็บที่ท้อง (abdominal tenderness) พบได้ร้อยละ 12- 27 และร้อยละ 35 ในผู้ป่วยที่ไม่มีและมีอาการเหลืองตามลำดับ ผู้ป่วยมักมีอาการเหลือง ในช่วงวันที่ 4-7 ของการดำเนินโรคและเป็นได้นานตั้งแต่ 2-3 วันจนถึงหลายสัปดาห์ ระดับบิริลูบินมักสูงสุด ในต้นสัปดาห์ที่สอง และมักพบสูงไม่เกิน 20 mg/dl แต่มีรายงานสูงได้ถึง 60-80 มก/ดล ตับโตพบได้บ่อยกว่า ม้ามโตและมักพบในรายที่มีอาการตัวและตาเหลือง ส่วนระดับเอ็นไซม์ transaminase (AST และ ALT) พบสูงกว่าปรกติได้บ่อย แต่มักไม่เกิน 5 เท่าทั้งและไม่สัมพันธ์กับภาวะตับโตหรือกดเจ็บกล้ามเนื้อ ระบบทางเดินปัสสาวะและไต การตรวจปัสสาวะและการทำงานของไตมีประโยชน์ในการแยกโรคเล็ปโตสไปโรสิสเป็นอย่างมาก เนื่องจากพบความผิดปรกติได้บ่อยถึงร้อยละ 50 80 ของผู้ป่วยทั้งหมด และพบความผิดปรกติได้ ตั้งแต่ระยะแรกของการดำเนินโรคซึ่งมักไม่พบในโรคติดเชื้อชนิดอื่น ๆ ที่มีอาการคล้ายคลึงกับโรคนี้ ความผิดปรกติที่พบได้บ่อยได้แก่ มีไข่ขาวในปัสสาวะ หรือพบเม็ดเลือดขาว หรือเม็ดเลือดแดง ส่วนระดับยูเรียในเลือด (BUN) พบเพิ่มสูงกว่าปรกติได้บ่อยในรายที่มีอาการตัวและตาเหลือง ส่วนระดับครีอะตินิน (creatinine) ที่สูงเกินปรกติมากกว่า 2 เท่ามักพบในรายที่อาการรุนแรง ผู้ป่วยที่มีระดับยูเรียสูงมากไม่เป็นสัดส่วนกับระดับครีอะตินินและอาจมีภาวะความดันต่ำร่วมด้วย มักเกิดจากมีภาวะขาดสารน้ำร่วมด้วย ผู้ป่วยกลุ่มนี้เมื่อได้รับการรักษาด้วยสารน้ำทดแทนที่เหมาะสม ความดันโลหิตและระดับยูเรียมักกลับเป็นปรกติในเวลารวดเร็ว ในรายที่มีภาวะไตวายซึ่งเกิดจาก การอักเสบของไตร่วมด้วย แบ่งเป็นสองกลุ่มได้แก่ กลุ่มที่มีปัสสาวะออกน้อย (oliguric renal failure) และกลุ่มที่ยังมีปัสสาวะมากกว่า 400 ซี.ซี. ต่อวัน (non-oliguric renal failure) ผู้ป่วยกลุ่มหลัง พบได้บ่อยกว่า (2ใน 3) และมีการพยากรณ์โรคดีกว่า ระบบทางเดินหายใจ อาการผิดปรกติเกี่ยวกับระบบทางเดินหายใจพบได้ตั้งแต่ร้อยละ 17-70 โดยอาการที่พบบ่อย มักจะไม่รุนแรงเช่น อาการไอเสมหะเล็กน้อยซึ่งมักเริ่มเป็นตั้งแต่วันที่ 1- 4 ของโรคและเป็นอยู่นาน 3- 4 วัน อาจมีอาการเจ็บหน้าอกซึ่งเป็นผลจากการอักเสบของกล้ามเนื้อได้ ส่วนอาการที่รุนแรงแต่พบได้น้อย และมักพบในกลุ่มที่มีอาการตัวและตาเหลือง ได้แก่ อาการไอเป็นเลือด ซึ่งอาจรุนแรงและเป็นสาเหตุ การเสียชีวิตได้โดยตรง อาการไอเป็นเลือดมีรายงานพบได้แตกต่างกันตั้งแต่ร้อยละ 3 50 ของผู้ป่วย โดยผู้ป่วยที่เสียชีวิตมักมีภาวะการหายใจล้มเหลว (acute respiratory distress syndrome, ARDS) ร่วมด้วย |
||||
| ภาพรังสีปอดผิดปรกติพบได้ตั้งแต่ร้อยละ 11- 67 โดยพบบ่อยในรายที่มีอาการ และอาการแสดงทางระบบทางเดินหายใจที่กล่าวไปแล้ว อาทิเช่น จากการศึกษาของ Wang และคณะ พบว่า ผู้ป่วยที่ไอเสมหะปนเลือดมีภาพถ่ายรังสีปอดผิดปรกติถึงร้อยละ 82 เปรียบเทียบกับร้อยละ 39 ในรายที่ ไม่มีอาการดังกล่าว เป็นต้น และยังพบว่าความรุนแรงหรือปริมาณเสมหะปนเลือดมีความสัมพันธ์กับความรุนแรงที่ ประเมินจากความผิดปรกติของภาพถ่ายรังสีปอดด้วย ผู้ป่วยโรคนี้มักพบภาพถ่ายรังสีปอดผิดปรกติทั้ง 2 ข้างและ เด่นที่บริเวณชายปอดเนื่องจากเป็นบริเวณที่มีปริมาณเลือดไหลเวียนมากที่สุด มักพบในวันที่ 3-9 ของการดำเนินโรค และกลับเป็นปรกติในเวลา 1- 2 สัปดาห์ขึ้นกับความรุนแรงของโรค ความผิดปรกติของการตรวจภาพรังสีปอดที่อาจพบได้ ได้แก่ patchy alveolar infiltration หรือ multiple nodular lesion ซึ่งเป็นผลมาจากการที่มีเลือดออกภายในถุงลมเป็นหย่อม ๆ บางรายอาจพบ confluent areas of air-space consolidation นอกจากนั้นความผิดปรกติที่พบบ่อยได้แก่ reticular infiltration, diffused, ill-defined ground-glass infiltrate ความผิดปรกติอื่น ๆ ที่พบได้น้อยกว่าได้แก่ generalized interstitial infiltration, miliary infiltration, atelectatic changes และการตรวจพบน้ำในช่องเยื่อหุ้มปอด | ||||
| การศึกษาในประเทศไทยพบว่า อาการไอ หอบเหนื่อย พบได้บ่อยเช่นกัน โดยอาการไอเป็นเลือด พบได้ประมาณร้อยละ 10 ภาพรังสีปอดผิดปรกติพบบ่อยมากกว่าร้อยละ 50 โดยพบลักษณะ reticular infiltration ได้บ่อยที่สุดประมาณร้อยละ 50 และพบ air-space nodules ประมาณ 1 ใน 4 นอกจากนั้นพบว่ามีหัวใจโตผิดปรกติ เกือบร้อยละ 50 และลักษณะความผิดปรกติที่เข้าได้กับภาวะ congestive heart failure (หัวใจโตร่วมกับ pulmonary congestion) อีกเกือบ1 ใน 4 ระบบประสาท อาการและการแสดงที่พบได้ เช่น ปวดศีรษะ พบเกือบทุกราย อาการคอแข็งพบได้ร้อยละ 27- 37 นอกจากนั้นมีรายงานพบผู้ป่วยที่มีระดับความรู้สึกตัวผิดปรกติหรือตรวจพบความผิดปรกติของระบบ ประสาทกลางส่วนต่าง ๆ ได้ โดยบางรายงานพบได้บ่อยถึงร้อยละ 20 ผู้ป่วยกลุ่มนี้อาจมีอาการ ผิดปรกติทางระบบประสาทเป็นสำคัญโดยไม่มีอาการอื่นๆที่พบบ่อยในโรคเลปโตสไปโรสิส เช่น ตัวและตาเหลือง หรือไตวายร่วมด้วย ซึ่งทำให้แพทย์ไม่คิดถึงการวินิจฉัยโรคนี้ กลุ่มอาการ aseptic meningoencephalitis มักพบในระยะที่ 2 ของการดำเนินโรค ซึ่งเชื่อว่าเป็นผลจากปฏิริยาการจับตัวของแอนติเจนและแอนติบอดีจำเพาะที่ร่างกายสร้างขึ้น การตรวจน้ำไขสันหลังอาจพบเชื้อได้ในระยะแรกของโรคโดยที่เซลล์เม็ดเลือดขาวไม่เพิ่มขึ้น ในสัปดาห์ที่สองของการดำเนินโรคเมื่อร่างกายมีการสร้างภูมิคุ้มกันเชื้อจะหายไปแต่จะเริ่มพบเซลล์มากขึ้นได้ แต่จำนวนเซลล์ที่เพิ่มขึ้นมักไม่เกิน 500 ตัว/มคล.และมักเป็นเม็ดเลือดขาวชนิดนิวโทรฟิลที่เพิ่มขึ้นในระยะแรก ระดับโปรตีนในน้ำไขสันหลังอาจปรกติหรือสูง (แต่มักไม่เกิน 300 มก.ต่อ ดล.) ส่วนระดับน้ำตาลในน้ำไขสันหลัง มักปรกติ ผู้ป่วยส่วนหนึ่งไม่มีอาการแสดงของเยื่อหุ้มสมองอักเสบแม้จะตรวจพบความผิดปรกติดังกล่าว ระบบหัวใจและหลอดเลือด ความผิดปรกติของระบบหัวใจและหลอดเลือดมีรายงานน้อย ส่วนมากเป็นรายงานพบคลื่นไฟฟ้าหัวใจ ผิดปรกติโดยไม่มีอาการแสดงทางคลินิกซึ่งอาจพบได้บ่อยถึง 2 ใน 3 ของผู้ป่วยโรคเล็ปโตสไปโรสิส ที่มีภาวะแทรกซ้อนในระบบอื่นๆ เช่น ตัวและตาเหลือง หรือไตวาย คลื่นไฟฟ้าหัวใจผิดปรกติที่พบบ่อย ได้แก่ หัวใจเต้นผิดจังหวะโดยพบ atrial fibrillation ได้บ่อยที่สุด นอกจากนี้อาจพบคลื่นไฟฟ้าหัวใจ ซึ่งบ่งถึงความผิดปรกติของ conduction system ชนิดต่างๆ โดยมีรายงานพบ first degree atrioventricular block ได้บ่อยที่สุด หรือความผิดปรกติที่อาจเกิดจากกล้ามเนื้อหัวใจอักเสบ (myocarditis) หรือเยื่อหุ้มหัวใจอักเสบ (pericarditis) เช่น ST segment elevation เป็นต้น คลื่นไฟฟ้าหัวใจที่ ผิดปรกติเหล่านี้มักกลับเป็นปรกติหลังการรักษา รายงานจากประเทศบราซิล อินเดีย และประเทศไทยในระยะหลัง พบผู้ป่วยที่มีภาวะผิดปรกติทาง ระบบหลอดเลือดและหัวใจซึ่งมีความรุนแรงต่างๆ กันมากขึ้น โดยมีรายงานพบตั้งแต่ร้อยละ 20- 60 ของผู้ป่วยโรคนี้ ภาวะผิดปรกติที่พบบ่อยได้แก่ ความดันโลหิตต่ำ (systolic blood pressure น้อยกว่า 90 มม.ปรอทหรือ mean arterial pressure น้อยกว่า 70 มม.ปรอท) ผู้ป่วยที่ตรวจพบ ภาวะความดันโลหิตต่ำจำนวนหนึ่งไม่มีอาการผิดปรกติอื่นๆทางระบบหลอดเลือดและหัวใจ ความผิดปรกติอื่น ๆ ที่พบบ่อยได้แก่ หัวใจโตจากการตรวจภาพรังสีปอดโดยไม่สัมพันธ์กับอาการแสดงทางคลินิก ในรายที่มีอาการรุนแรงอาจพบภาวะการทำงานของหัวใจล้มเหลว (congestive heart failure) จากกล้ามเนื้อหัวใจอักเสบหรือเยื่อหุ้มหัวใจอักเสบ ผู้ป่วยกลุ่มที่มีอาการไม่รุนแรงเมื่อตรวจการทำงานของ หัวใจด้วยเครื่องตรวจคลื่นความถี่สูง (echocardiography) ไม่พบการทำงานของหัวใจห้องล่างซ้ายผิดปรกติ ส่วนผู้ป่วยที่เสียชีวิตพบว่ามีจุดเลือดออก (petichiae hemorrhage) ร่วมกับการอักเสบของกล้ามเนื้อหัวใจ และเยื่อหุ้มหัวใจ ร่วมกับภาวะปอดบวมน้ำหรือ ARDS จากการตรวจศพ ความผิดปรกติทางระบบหัวใจ และหลอดเลือดดังกล่าวพบบ่อยในผู้ป่วยที่มีการทำงานของไตผิดปรกติ แต่ไม่มีความสัมพันธ์กับอาการตัวและตาเหลือง ระบบอื่น ๆ อาการตาแดง (conjunctival suffusion) พบได้อย่างน้อย 1 ใน 5 ของผู้ป่วยโรคนี้ มักพบในระยะสัปดาห์แรก ส่วนเลือดออกในเยื่อบุตาขาว (subconjunctival hemorrhage) พบได้น้อย 50 และมักหายได้เองในหนึ่งสัปดาห์ โดยไม่ต้องให้การรักษา นอกจากนั้นอาจพบการอักเสบของตา เช่น uveitis ซึ่งมักเป็น anterior uveitis แต่มีรายงานการเกิด panuveitis, retinal pheblitis, hypopeon ได้เช่นกัน อาจเกิดได้ตั้งแต่สัปดาห์ที่ 2 ของโรค จนถึง 6 - 12 เดือนหลังจากนั้น อาจเป็นข้างเดียวหรือสองข้าง ครั้งเดียวหรือเกิดซ้ำหลายครั้งก็ได้ โรคนี้จึงเป็นสาเหตุหนึ่งของ chronic recurrent uveitis แต่การพยากรณ์โรคดีมักหายเป็นปรกติได้ ยกเว้นในรายที่เป็นเรื้อรังมีโอกาสตาบอดได ้ จุดเลือดออก (petichial hemorrhage) พบไม่บ่อยและพบในรายที่มีตัวและตาเหลืองเท่านั้น ส่วนภาวะเกล็ดเลือดต่ำ (thrombocytopenia หรือ เกล็ดเลือด < 100,000/ มคล.) พบได้บ่อย ในผู้ป่วยที่มีอาการรุนแรง และมีรายงานพบความสัมพันธ์กับการเกิดภาวะไตวาย โดยมีรายงานผู้ป่วยที่มี ภาวะเกล็ดเลือดต่ำจะพบภาวะไตวายร่วมด้วยถึงร้อยละ 72 เปรียบเทียบกับร้อยละ 21 ในรายที่มีระดับ เกล็ดเลือดปรกติ นอกจากนั้นผู้ป่วยที่มีภาวะเกล็ดเลือดต่ำมักมีจำนวนเม็ดเลือดขาวสูง ระดับเกล็ดเลือด มักจะลดต่ำลงใน 3 วันแรกและกลับเพิ่มขึ้นมาจนปรกติใน 7 วัน พยาธิกำเนิดไม่เกี่ยวข้องกับภาวะ disseminated intravascular coagulation แต่น่าจะเกิดจากการภาวะ platelet adhesion และ platelet aggregation ที่บริเวณเซลล์เยื่อบุผนังหลอดเลือด ผู้ป่วยโรคนี้อาจมีจำนวนเม็ดเลือดขาวปรกติ หรือต่ำ (< 4,500 ตัว/มคล.) หรือสูง (>10,000ตัว/ มคล.) ทั้งนี้ในกลุ่มที่มีเม็ดเลือดขาวสูง มักมีจำนวนเม็ดเลือดขาวชนิดนิวโทรฟิลเพิ่มขึ้นเป็นส่วนใหญ่ และมีความสัมพันธ์กับภาวะเกล็ดเลือดต่ำดังกล่าวแล้ว |
||||
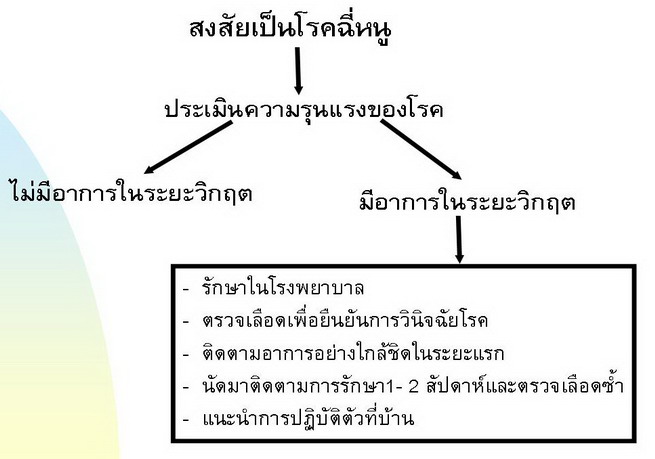
การวินิจฉัยโรค การวินิจฉัยทางคลินิก แบ่งเป็น - ผู้ป่วยที่สงสัยทางคลินิก (possible case หรือ suspected case) - ผู้ป่วยที่ได้รับการวินิจฉัยที่แน่นอน (confirmed case) ผู้ป่วยที่สงสัยทางคลินิกได้แก่ ผู้ป่วยที่มีอาชีพ หรือประวัติสัมผัสหรือเสี่ยงต่อการติดเชื้อ ซึ่งมีอาการไข้ฉับพลันและอาการอื่นๆที่พบบ่อยในโรคเล็ปโตสไปโรสิสดังกล่าวแล้ว โดยไม่มีอาการซึ่ง บ่งชี้สาเหตุของโรคติดเชื้ออื่น ๆ เช่น การติดเชื้อทางเดินหายใจ หรือปอดอักเสบ หรือการติดเชื้อในระบบอื่น ๆ เนื่องจากอาการทางคลินิกของโรคเล็ปโตสไปโรสิสเกิดจากภาวะ leptospiremia ร่วมกับภาวะแทรกซ้อนต่าง ๆ ซึ่งเกิดได้ทั่วร่างกาย ทำให้พบว่าผู้ป่วยโรคนี้มีอาการทางคลินิกเป็นกลุ่มอาการต่างๆมากมาย อาทิเช่น 1. กลุ่มอาการไข้ฉับพลัน (acute febrile illness)ได้แก่ ผู้ป่วยที่มีอาการไข้ร่วมกับอาการปวดศีรษะ ปวดเมื่อยกล้ามเนื้อ ตาแดง ฯลฯ โดยไม่มีอาการตัวและตาเหลือง หรืออาการซึ่งเกิดจากภาวะแทรกซ้อนอื่น ๆ 2. กลุ่มอาการไข้ฉับพลันร่วมกับอาการตัวและตาเหลือง (acute acalculous cholecystitis) อาจพบว่ามีตับโต กดเจ็บร่วมด้วย โดยไม่พบความผิดปรกติของการทำงานของไต 3. กลุ่มอาการไข้ฉับพลันร่วมกับความผิดปรกติของการทำงานของไต เช่น การตรวจปัสสาวะพบความผิดปรกติ หรือพบการเพิ่มขึ้นของระดับยูเรีย หรือ ครีอะตินิน โดยไม่พบอาการตัวและตาเหลือง 4. กลุ่มอาการไข้ฉับพลันร่วมกับอาการตัวและตาเหลือง และความผิดปรกติ ของการทำงานของไตร่วมด้วย (Weil 's syndrome) 5. กลุ่มอาการไข้ฉับพลันร่วมกับความผิดปรกติทางระบบประสาท เช่น ความรู้สึกตัวผิดปรกติ (encephalopathy) หรือเยื่อหุ้มสมองอักเสบ (aseptic meningitis) เป็นต้น 6. กลุ่มอาการไข้ฉับพลันร่วมกับอาการทางระบบหายใจ เช่น ไอเป็นเลือด หอบเหนื่อย การหายใจล้มเหลว เป็นต้น ผู้ป่วยที่ตรวจพบกลุ่มอาการต่าง ๆ เหล่านี้จะให้การวินิจฉัยเบื้องต้นว่าเป็นโรคเล็ปโตสไปโรสิส ได้โดยการซักประวัติและตรวจร่างกายแล้วพบว่า ผู้ป่วยมีปัจจัยเสี่ยงต่อการติดเชื้อ leptospires และไม่พบสาเหตุการติดเชื้อชนิดอื่น ๆ หรือสาเหตุอื่นที่พบบ่อยกว่า เช่น ผู้ป่วยที่มีอาการไข้ฉับพลัน ร่วมกับอาการตัวและตาเหลือง แต่ไม่พบนิ่วในถุงน้ำดีหรือไม่มีประวัติดื่มสุราจัด หรือเป็นโรคตับเรื้อรัง ซึ่งเป็นสาเหตุของโรคทางเดินน้ำดีหรือถุงน้ำดีอักเสบเฉียบพลันที่พบบ่อย หรือผู้ป่วยที่อาการไข้ฉับพลัน ร่วมกับอาการหอบเหนื่อย หรือไอเป็นเลือด แต่ภาพรังสีปอดไม่พบลักษณะปอดอักเสบที่กลีบใดกลีบหนึ่ง และตรวจเสมหะไม่พบเชื้อก่อโรค เป็นต้น ดังนั้นจะเห็นได้ว่า การวินิจฉัยโรคเล็ปโตสไปโรสิสทางคลินิกจำเป็นต้องวินิจฉัยแยกโรคจากการติดเชื้อต่าง ๆ หลายชนิด ขึ้นกับกลุ่มอาการที่ผู้ป่วยมาพบแพทย์ โดยเฉพาะอย่างยิ่งในรายที่มีอาการรุนแรงต้องวินิจฉัยแยกโรค จากภาวะ community-acquired septicemia ซึ่งเชื้อก่อโรคที่พบบ่อยได้แก่ เชื้อแบคทีเรียกรัมลบ เช่น Escherichia coli, Klebsiella spp. หรือเชื้อกรัมบวก เช่น Staphylococcus aureus เป็นต้น ในรายที่มีอาการรุนแรงมากต้องวินิจฉัยแยกโรคจาก septicemic melioidosis ด้วยเสมอ เนื่องจากโรคเหล่านี้มีอัตราตายสูงและรักษาด้วยยาต้านจุลชีพที่ต่างกัน ข้อสังเกตซึ่งอาจช่วยในการ วินิจฉัยแยกโรคได้แก่ ผู้ป่วยโรคเมลิออยด์โดสิสส่วนใหญ่เป็นชาวนา และมักจะมีโรคประจำตัว โดยเฉพาะอย่างยิ่ง โรคเบาหวานและนิ่วในไตร่วมด้วย และภาพรังสีปอดที่ผิดปรกติในรายที่ เกิดจากภาวะ community-acquired septicemia มักเป็นลักษณะของ bacteremic pneumonia คือ เป็นpatchy infiltration หรือ cotton ball appearance และเป็นทั้งสองปอด นอกจากนี้ยังมี โรคหลายโรคซึ่งมีอาการและอาการแสดงไม่แตกต่างจากโรคเล็ปโตสไปโรสิสเลย เช่น โรคไข้รากสาดใหญ่หรือ scrub typhus ไข้เลือดออกที่มีอาการรุนแรง เป็นต้น ดังนั้นจึงต้องตรวจทางห้องปฏิบัติการเพื่อวินิจฉัยโรคเล็ปโตสไปโรสิสเสมอ |
||||
การรักษา ผู้ป่วยโรคเล็ปโตสไปโรสิสส่วนใหญ่มีการพยากรณ์โรคดีถ้าได้รับการวินิจฉัยที่ถูกต้องอย่างรวดเร็วและ การรักษาที่เหมาะสม ผู้ป่วยที่เสียชีวิตเกิดจากมีอาการแทรกซ้อนที่รุนแรงเช่น ไอเป็นเลือดที่รุนแรง การหายใจล้มเหลว หรือไตวาย เป็นต้น การศึกษาเกี่ยวกับปัจจัยที่มีผลต่ออัตราตายในผู้ป่วยโรคเลปโตสไปโรสิสโดย Dupont และคณะพบว่า ผู้ป่วยซึ่งมีภาวะหายใจลำบาก หรือภาวะไตวายที่มีปัสสาวะออกน้อย หรือภาพรังสีปอดผิดปกติแบบ alveolar infiltration หรือคลื่นไฟฟ้าหัวใจผิดปกติ หรือมีจำนวนเม็ดเลือดขาวเพิ่มขึ้นมากกว่า 12,900 /มคล. อย่างใดอย่างหนึ่งมีอัตราตายสูงกว่ารายที่ไม่มีความผิดปกติดังกล่าว การศึกษาจากประเทศบราซิลพบว่า ผู้ป่วยที่มีภาวะภาวะไตวายที่มีปัสสาวะออกน้อยมีอัตราตายสูง ส่วนการศึกษาในผู้ป่วยกลุ่มที่อาการไอเป็นเลือด และการหายใจล้มเหลวพบว่า ผู้ที่มีภาวะความดันโลหิตต่ำ หรือระดับcreatinine สูง หรือระดับสาร โปแตสเสียม ในเลือดสูงกว่า 4 มิลลิโมล/ลิตรร่วมด้วยมีอัตราตายสูงกว่าผู้ที่ไม่มีความผิดปกติดังกล่าวอย่างมีนัยสำคัญทางสถิติ การศึกษาในประทศไทยจากโรงพยาบาลขอนแก่น และโรงพยาบาลแพร่ พบว่า ผู้ป่วยกลุ่มที่มี อาการไอเสมหะปนเลือด หรืออัตราการหายใจ >24 ครั้ง/นาที หรือความดันโลหิตต่ำ หรือภาวะ oliguria หรือระดับโปแตสเสียมในเลือด สูงกว่า 5 มิลลิโมล/ลิตร หรือจำนวนเกร็ดเลือด <100, 000/มคล. อย่างใดอย่างหนึ่งมีอัตราเสี่ยงต่อการ เสียชีวิตสูงกว่ากลุ่มที่ไม่มีอาการและการตรวจพบดังกล่าวตั้งแต่ 1.1 18 เท่า |
||||
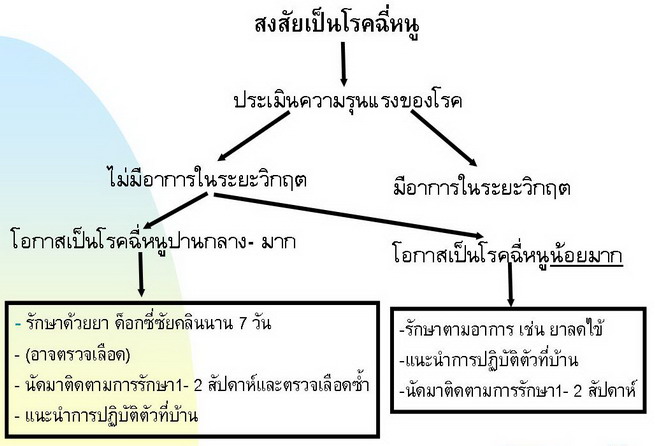
การรักษาตามอาการ ในรายที่มีอาการไข้ฉับพลันโดยไม่มีภาวะแทรกซ้อนหรือการตรวจพบดังกล่าวข้างต้น ได้แก่ การให้ยาลดไข้ ซึ่งไม่ใช่ยาในกลุ่มต้านการอักเสบที่ไม่ใช่สตีรอยด์ (non-steroid anti-inflammatory drug, NSAIDs) เป็นต้น ส่วนในรายที่มีอาการรุนแรง หรือมีการตรวจพบอย่างใดอย่างหนึ่งซึ่งบ่งชี้ว่าอาจมีการดำเนินโรคที่รุนแรงต่อไปได้ควร รับการรักษาในโรงพยาบาลเพื่อเฝ้าระวังอาการอย่างใกล้ชิด โดยเฉพาะการวัดความดันโลหิต และการวัดปริมาณปัสสาวะบ่อยๆ ในระยะแรก ถ้าพบว่ามีอาการแสดงของการขาดสารน้ำ เช่น orthostatic hypotension หรือ ความดันโลหิตต่ำ หรือปัสสาวะออกน้อย หรือเริ่มมีความผิดปรกติ ของการทำงานของไต ควรให้สารน้ำอย่างพอเพียง แล้วติดตามวัดปริมาณปัสสาวะเพื่อประเมินผลการรักษา ต้องระวังการให้สารน้ำมากเกินไปด้วยในรายที่ปัสสาวะออกน้อย การรักษาตามอาการอื่น ๆ ขึ้นกับภาวะแทรกซ้อนที่พบ ผู้ป่วยที่มีภาวะไตวายหรือเลือดออกผิดปรกติ โดยเฉพาะอย่างยิ่งถ้าผู้ป่วยเริ่มหรือมีอาการไอเป็นเลือดร่วมด้วยควรรับไว้รักษาในหออภิบาล เนื่องจากอัตราตายสูงมาก ต้องได้รับการรักษาด้วยใส่เครื่องช่วยหายใจอย่างทันท่วงทีและเตรียมการรักษา ภาวะ acute respiratory distress syndrome เมื่อพบว่าเริ่มมีภาวะการหายใจล้มเหลว มีรายงานเบื้องต้นว่า การรักษาผู้ป่วยโดยใช้ก๊าซ nitric oxide ทางการหายใจร่วมกับการทำ hemofiltration ในผู้ป่วย 1 ราย ที่มีอาการไอเป็นเลือดปริมาณมากร่วมกับภาวะ ARDS ว่า ทำให้ผู้ป่วยรอดชีวิตได้ นอกจากนั้นมีรายงานผล การรักษาผู้ป่วยที่มีอาการเลือดออกในปอด 8 รายที่ได้รับการใช้ยาสตีรอยด์ขนาดสูงมาก พบว่าอัตราตาย ร้อยละ 20 เปรียบเทียบร้อยละ 80 ในผู้ป่วยอีก 5 รายที่ไม่ได้รับการรักษาด้วยยาสตีรอยด์ และมีรายงาน การรักษาผู้ป่วยที่มีอาการเลือดออกในปอดรุนแรง 6 รายด้วยยา desmopressin หยดเข้าหลอดเลือดดำพบว่า ทำให้ภาวะเลือดออกในปอดหยุดอย่างรวดเร็วเช่นกัน อย่างไรก็ตามยังไม่มีผลการศึกษาทางคลินิกแบบ สุ่มยืนยันประสิทธิภาพของการรักษาเหล่านี้ ในรายที่มีภาวะไตวายควรเฝ้าระวังผู้ป่วยอย่างใกล้ชิดและ ให้การรักษาด้วยการทำ hemodialysis หรือ peritoneal dialysis อย่างรวดเร็วในรายที่ปัสสาวะเริ่มออกน้อย เป็นต้น ในรายที่มีภาวะตับวายให้การรักษาเหมือนผู้ป่วยที่มีภาวะตับวายจากสาเหตุอื่นๆ เช่น งดอาหารโปรตีน ป้องกันภาวะเสียสมดุลย์ของสาร electrolytes ต่างๆโดยเฉพาะสาร potassium เป็นต้น ไม่มีหลักฐานว่าการให้เกล็ดเลือดทดแทนในรายที่มีเกล็ดเลือดต่ำจะป้องกันภาวะเลือดออกผิดปรกติได้ จึงควรพิจารณาให้เฉพาะรายที่มีปัญหาเลือดออกผิดปรกติเท่านั้น การรักษาตามอาการเหล่านี้มีความสำคัญ เป็นอย่างมากเท่ากับการรักษาจำเพาะด้วยยาต้านจุลชีพ |
||||
การรักษาจำเพาะ เชื้อ leptospires เป็นแบคทีเรียที่ไวต่อยาต้านจุลชีพหลายชนิด ยาต้านจุลชีพที่มีการทดสอบพบว่า มีความไวในหลอดทดลองต่อเชื้อนี้ได้แก่ penicillin, ampicillin, amoxicillin, doxycycline, tetracycline, erythromycin ยาในกลุ่ม cephalosporin ได้แก่ cefotaxime และ ceftriaxone รวมทั้งยา azithromycin, ยา telithromycin, และยา ในกลุ่ม quinolone ได้แก่ ciprofloxacin, moxifloxacin ผลการศึกษาพบว่า ยา chloramphenicol มีค่า MIC และ MBC90 สูงกว่ายาดังกล่าวทั้งหมดมาก ยาในกลุ่ม macrolides ได้แก่ยา erythromycin และยา azithromycin มีความไวต่อเชื้อสูงมาก (มีค่า MIC ≤ 0.01มคก/ลิตร). และยาในกลุ่ม ketolide คือยา telithromycin มีความไวต่อเชื้อนี้สูงสูงสุด ยาต้านจุลชีพผสมในกลุ่มที่มีเอ็นไซม์ betalactamase inhibitor เช่น ยา ampicillin salbactam มีความไวต่อเชื้อนี้เช่นกัน การศึกษาทางคลินิกพบว่า ผู้ป่วยซึ่งอาการไม่รุนแรงอาจหายได้เอง แต่อาการทางคลินิกต่าง ๆ โดยเฉพาะอาการไข้จะลดลงเร็วกว่าเมื่อได้รับการรักษาด้วยยาต้านจุลชีพที่เหมาะสม โดยเฉพาะในรายที่ ได้รับการรักษาภายใน 4 วันหลังเริ่มมีอาการไข้ ส่วนในผู้ป่วยที่มีอาการรุนแรงแม้ว่า ข้อมูลจากการ ศึกษาประสิทธิผลของการใช้ยาต้านจุลชีพในการรักษาผู้ป่วยโรคนี้จะยังไม่สามารถสรุปได้ว่า การรักษาด้วยยาต้านจุลชีพโดยเฉพาะในรายที่มีอาการมานานเกิน 4 วันก่อนเริ่มการรักษา จะมีประโยชน์ในการลดอัตราตาย หรือลดอัตราการเกิดภาวะแทรกซ้อน หรือทำให้ระยะการดำเนินโรคเช่น ระยะเวลาที่มีไข้ หรือการทำงานของตับ ไตที่ผิดปรกติสั้นลงกว่าการรักษาประคับประคองเท่านั้นหรือไม่ ในทางปฏิบัติแพทย์ผู้ดูแลผู้ป่วยมักให้ยาต้านจุลชีพในการรักษาผู้ป่วยด้วย ยาต้านจุลชีพที่มีรายงาน การศึกษาประสิทธิภาพในการรักษาผู้ป่วยเล็ปโตสไปโรสิสได้แก่ 1. Penicillin G sodium ขนาด 1.5- 2 ล้านยูนิต ฉีดเข้าหลอดเลือดดำวันละ 4- 6 ครั้งนาน 7 วัน ซึ่งผลการศึกษาแบบ randomized placebo controlled trial ในผู้ป่วยเล็ปโตสไปโรสิสที่มีอาการรุนแรง ที่ประเทศฟิลิปปินส์พบว่า การรักษาด้วยยา penicillin ทำให้อาการไข้และการดำเนินโรคสั้นลง และกำจัดเชื้อจากปัสสาวะได้รวดเร็วกว่าอย่างมีนัยสำคัญเมื่อเปรียบเทียบกับยาหลอก ไม่ว่าจะเริ่มรักษาเมื่อผู้ป่วยมีไข้มานานกี่วัน แต่ในขณะเดียวกันรายงานการศึกษาทางคลินิก แบบสุ่มจากประเทศบาเบดอสและบราซิลในผู้ป่วยที่มีอาการรุนแรงเช่นเดียวกันและมีอาการไข้ มานานเกิน 4 วันพบว่า ผลการรักษาได้แก่ อัตราตาย หรือระยะเวลาที่มีไข้หลังการรักษา หรือระยะเวลาการทำงานของตับ ไตที่กลับเป็นปรกติหลังการรักษา ในกลุ่มที่ได้รับยา penicillin ไม่แตกต่างกับกลุ่มที่ได้รับการรักษาประคับประคองเท่านั้น 2. Doxycycline กินครั้งละ 100 มก.วันละ 2 ครั้งนาน 7 วัน ในรายที่มีอาการไม่รุนแรง การศึกษาแบบ randomized placebo controlled trial พบว่า การรักษาด้วยยา doxycycline ทำให้ไข้ลดลงเร็วกว่ายาหลอกอย่างมีนัยสำคัญทางสถิติโดยเฉลี่ย (3.7 ± 0.3 วันเปรียบเทียบกับ 5.4 ± 0.3 วันตามลำดับ P= 0.01) รวมทั้งอาการอื่นๆ เช่น ระยะเวลาปวดกล้ามเนื้อ ปวดศีรษะลดลงอย่างมีนัยสำคัญเช่นเดียวกัน และในรายที่มีอาการรุนแรงพบว่า การรักษาด้วยยา doxycycline ชนิดฉีดมีประสิทธิภาพในการรักษาผู้ป่วยโรคนี้ไม่แตกต่างจากยา penicillin หรือ cefotaxime 3. Ampicillin หรือ amoxycillin มีรายงานว่า น่าจะมีประโยชน์ในการรักษาโรคนี้เช่นเดียวกัน 4. Chloramphenicol การศึกษาทางคลินิกพบว่า ไม่มีประสิทธิภาพในการรักษาผู้ป่วยโรคนี้ 5. Ceftriaxone ขนาด 1 กรัมฉีดเข้าหลอดเลือดดำวันละครั้งนาน 7 วัน การศึกษาแบบสุ่ม ในผู้ป่วยที่มีอาการรุนแรงปานกลางถึงมากที่โรงพยาบาลขอนแก่น พบว่า cetriaxone มีประสิทธิภาพในการรักษาผู้ป่วยโรคนี้ไม่แตกต่างจากยา penicillin 6. Cefotaxime การศึกษาแบบสุ่มที่โรงพยาบาลศูนย์อุดรธานี โรงพยาบาลมหาราชนครราชสีมา โรงพยาบาลเลย และโรงพยาบาลบ้านใหม่ไชยพจน์ จังหวัดบุรีรัมย์ พบว่า ยา cefotaxime มีประสิทธิภาพในการรักษาผู้ป่วยโรคนี้ที่มีอาการรุนแรงเช่นเดียวกับยา penicillin และ doxycycline ชนิดฉีด 7. Azithromycin การศึกษาในห้องปฏิบัติการพบว่า เป็นยาต้านจุลชีพที่มีความไวสูงต่อเชื้อนี้ดังกล่าวแล้ว ผลการศึกษาแบบสุ่มเบื้องต้นในประเทศไทยพบว่า น่าจะมีประสิทธิภาพในการรักษาผู้ป่วยที่มีอาการไม่รุนแรง |
||||
แนวทางการเลือกใช้ยาต้านจุลชีพสำหรับโรคนี้โดยสรุปเป็นดังต่อไปนี้ รายที่มีอาการไม่รุนแรงและให้การรักษาแบบผู้ป่วยนอก ให้การรักษาเป็นเวลา 7 วันโดยเลือกใช้ยาต้านจุลชีพตามลำดับต่อไปนี้ - Doxycycline ขนาด100 มิลลิกรัมวันละ 2 ครั้ง หลังอาหารทันที หรือ - Amoxycillin ครั้งละ 500 มิลลิกรัม ก่อนอาหาร วันละ 4 ครั้งในรายที่มีอาการ คลื่นไส้อาเจียนหรือมีข้อห้ามใช้ยา doxycycline รายที่มีอาการรุนแรงหรืออาจมีภาวะแทรกซ้อนและรับไว้รักษาในโรงพยาบาล - Penicillin G Sodium 1.5- 2 ล้านยูนิต ฉีดเข้าหลอดเลือดดำ ทุก 4- 6 ชั่วโมง - Doxycycline ขนาด 200 มิลลิกรัมหยดเข้าหลอดเลือดดำช้า ๆ แล้วตามด้วยยาขนาด 100 มิลลิกรัมหยดเข้าหลอดเลือดดำทุก 12 ชั่วโมง ถ้าวินิจฉัยแยกโรคจาก scrub typhus ไม่ได้ - Ceftriaxone 1 กรัมฉีดเข้าหลอดเลือดดำวันละ 1 ครั้งหรือ cefotaxime 1 กรัม ฉีดเข้าหลอดเลือดดำทุก 6 ชั่วโมงถ้าวินิจฉัยแยกโรคจากการติดเชื้อ Gram negative bacteria หรือ sepsis ไม่ได้ เนื่องจากผลการศึกษาในประเทศไทยพบว่า อาการทางคลินิกของผู้ป่วยโรคเล็ปโตสไปโรสิสที่มีอาการรุนแรง คล้ายคลึงกับโรค scrub typhus ที่มีอาการรุนแรงหรือการติดเชื้อ Gram negative bacteria หรือ sepsis มาก ในผู้ป่วยที่มีอาการรุนแรงมากมักไม่สามารถให้การวินิจฉัยแยกโรคดังกล่าวได้ในระยะแรก ดังนั้นอาจพิจารณา เริ่มให้การรักษาผู้ป่วยกลุ่มนี้ด้วยยา Ceftriaxone หรือ cefotaxime ร่วมกับยา doxycycline และปรับเปลี่ยน ยาต้านจุลชีพให้เหมาะสมใน 48- 72 ชั่วโมงต่อมาโดยพิจารณาจากการตอบสนองทางคลินิกของผู้ป่วยและ ผลการเพาะเชื้อจากเลือดว่า พบเชื้อแบคทีเรียอื่นๆหรือไม่ ร่วมกับผลการตรวจทางห้องปฏิบัติการเพื่อวินิจฉัยโรคนี้ซ้ำอีกครั้งหนึ่ง เมื่อผู้ป่วยอาการดีขึ้น เปลี่ยนเป็นยากินให้ครบ 7 วันและนัดมาเจาะเลือดตรวจเพื่อการวินิจฉัยโรคที่แน่นอนภายใน 1- 4 สัปดาห์ |
||||
 |
||||
 |
||||
| การป้องกันการติดเชื้อเลปโตสไปโรซิส | ||||
| 1. การให้ยาป้องกันการติดเชื้อเลปโตสไปโรซิส จากการศึกษาของ Takafuji และคณะ พบว่า ยาด็อกซี่ซัยคลิน 200มก/สัปดาห์ก่อนสัมผัส , ระหว่างการสัมผัส 200 มก/สัปดาห์ และ 4- 6 สัปดาห์ หลังการสัมผัส ลดอัตราการติดเชื้อจาก 4.2 % เหลือ 0.2 % (95% protective) 2. การป้องกันการติดเชื้อเลปโตสไปโรซิสโดยไม่ใช้ยา 2.1 กำจัดหนู หรือสัตว์พาหะอื่น ๆ 2.2 หลีกเลี่ยงการสัมผัสเชื้อ เช่น หลีกเลี่ยงการย่ำน้ำท่วมขัง,ใส่รองเท้าบู้ท 2.3 รักษาอย่างรวดเร็วหลังมีอาการทางคลินิก 2.4 วัคซีน ยังมีข้อจำกัดอยู่เนื่องจาก เชื้อมีความหลากหลาย และ ภูมิคุ้มกันจากการติดเชื้อป้องกันเฉพาะสายพันธุ์ |
||||
